باران اسیدی
|
  |
یکی از مشکلات جدی محیط زیست که امروزه بشر در اکثر نقاط جهان با آن درگیر است، باران اسیدی میباشد. باران اسیدی به پدیدههایی مانند مه اسیدی و برف اسیدی که با نزول مقادیر قابل توجهی اسید از آسمان همراه هستند، اطلاق میشود.
باران هنگامی اسیدی است که میزان PH آب آن کمتر از 5،6 باشد. این مقدار PH بیانگر تعادل شیمیایی بوجود آمده میان دیاکسید کربن و حالت محلول آن یعنی بیکربنات (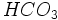 ) در آب خالص است. ) در آب خالص است.
باران اسیدی دارای نتایج زیانبار اکولوژیکی میباشد و وجود اسید در هوا نیز بر روی سلامتی انسان اثر مستقیم دارد. همچنین بر روی پوشش گیاهی تأثیرات نامطلوبی میگذارد. |

دید کلی
در چند دهه اخیر میزان اسیدیته آب باران ، در بسیاری از نقاط کره زمین افزایش یافته و به همین خاطر اصطلاح باران اسیدی رایج شده است. برای شناخت این پدیده سوالات زیادی مطرح گردیده است که به عنوان مثال میتوان به این موارد اشاره کرد: چه عناصری باعث تغییر طبیعی باران میشوند؟ منشا این عناصر چیست؟ این پدیده در کجا رخ میدهد؟
معمولا نزولات جوی به علت حل شدن دیاکسید کربن هوا در آن و تشکیل اسید کربنیک بطور ملایم اسیدی هستند و PH باران طبیعی آلوده نشده حدود 5.6 میباشد. پس نزولاتی که به مقدار ملاحظهای قدرت اسیدی بیشتری داشته باشند و PH آنها کمتر از 5 باشد، باران اسیدی تلقی میشوند.
تاریخچه
پدیده باران اسیدی در سالهای پایانی دهه 1800 در انگلستان کشف شد، اما پس از آن تا دهه 1960 به دست فراموشی سپرده شد. « اسمیت » در سال 1873 واژه باران اسیدی را برای اولین بار مطرح کرد. او پی برد که ترکیب شیمیایی باران تحت تاثیر عواملی چون جهت وزش باد ، شدت بارندگی و توزیع آن ، تجزیه ترکیبات آبی و سوخت میباشد. این محقق متوجه اسید سولفوریک در باران شد و عنوان نمود که این امر ، برای گیاهان و اشیا واقع در سطح زمین خطرناک است.
« موتا » و « میلو » در سال 1987 عنوان داشتند که دیاکسید کربن با اسید سولفوریک و اسید نیتریک عوامل اصلی تعیین کننده میزان اسیدی بودن آب باران هستند، چرا که در یک فاز آبی به صورت یونهای نیترات و سولفات در میآیند و چنین یونهایی به آب باران خاصیت اسیدی میبخشند.
عوامل موثر در اسیدیته باران
آب باران هیچگاه ، کاملا خالص نبوده و با پیشرفت صنعت بر ناخالصیهای آن افزوده شده است. ناخالصی طبیعی باران بطور عمده ناشی از نمکهای دریایی است و گازها و دودهای ناشی از فعالیت انسان در فرآیند ابرها دخالت میکنند.
آتش سوزی جنگلها نیز ، از جمله عواملی است که در میزان اسیدیته آب باران نقش دارد. فرآیندهای بیولوژیکی ، آتشفشانی و فعالیتهای انسان ، مواد آلوده کننده جو را در مقیاس محلی ، منطقهای و جهانی در فضا منتشر میکنند. به عنوان مثال ، در صورت وجود جریانات باد در نواحی صنعتی ، مواد خارج شده از دودکشهای کارخانهها در سطح وسیعی در فضا پراکنده میشوند.
اسیدهای موجود در باران اسیدی
اسیدهای عمده در باران اسیدی ، اسید سولفوریک و اسید نیتریک میباشد. بطور کلی این اسیدها به هنگام حمل توده هوایی که آلایندههای نوع اول مثل  و و 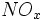 را دربر دارند، بوجود میآیند. از این رو معمولا محل نزول باران اسیدی دورتر از منبع آلایندهها میباشد. باران اسیدی یک مشکل آلودگی است که به علت حمل دوربرد آلایندههای هوا توسط باد حد و مرز جغرافیایی نمیشناسد. را دربر دارند، بوجود میآیند. از این رو معمولا محل نزول باران اسیدی دورتر از منبع آلایندهها میباشد. باران اسیدی یک مشکل آلودگی است که به علت حمل دوربرد آلایندههای هوا توسط باد حد و مرز جغرافیایی نمیشناسد.
بطور کلی در مقیاس جهانی بیشتر  بوسیله آتشفشانها و توسط اکسایش گازهای گوگرد حاصل از تجزیه گیاهان تولید میشود. این دیاکسید گوگرد طبیعی معمولا در قسمتهای بالای جو انتشار مییابد. بنابراین غلظت آن در هوای پاکیزه ناچیز میباشد. منبع عمده تولید بوسیله آتشفشانها و توسط اکسایش گازهای گوگرد حاصل از تجزیه گیاهان تولید میشود. این دیاکسید گوگرد طبیعی معمولا در قسمتهای بالای جو انتشار مییابد. بنابراین غلظت آن در هوای پاکیزه ناچیز میباشد. منبع عمده تولید  ناشی از فعالیتهای انسانی احتراق زغالسنگ میباشد. ناشی از فعالیتهای انسانی احتراق زغالسنگ میباشد.
دیاکسید گوگرد بوسیله صنعت نفت به هنگام پالایش نفت یا تصفیه گاز طبیعی مستقیما یا به صورت 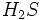 در هوا انتشار مییابد. بیشتر کانیهای با ارزش در طبیعت به صورت سولفید یافت میشود. بنابراین هنگام استخراج و تبدیل آنها به فلز آزاد مقداری در هوا انتشار مییابد. بیشتر کانیهای با ارزش در طبیعت به صورت سولفید یافت میشود. بنابراین هنگام استخراج و تبدیل آنها به فلز آزاد مقداری  در هوا آزاد میشود و در اثر ترکیب با ذرات ریز بخار آب به در هوا آزاد میشود و در اثر ترکیب با ذرات ریز بخار آب به 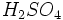 تبدیل میگردد و در اثر کاهش دما در قسمتهای بالای جو به صورت باران اسیدی به زمین برمیگردد. تبدیل میگردد و در اثر کاهش دما در قسمتهای بالای جو به صورت باران اسیدی به زمین برمیگردد.
منابع تولید اکسیدهای نیتروژن
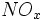 در هوای غیر آلوده به مقدار کم در اثر ترکیب اکسیژن و نیتروژن موجود در هوا هنگام رعد و برق ، وجود دارد و همچنین مقداری هم از رها شدن اکسیدهای نیتروژن از منابع زیستی حاصل میشود، اما در هوای غیر آلوده به مقدار کم در اثر ترکیب اکسیژن و نیتروژن موجود در هوا هنگام رعد و برق ، وجود دارد و همچنین مقداری هم از رها شدن اکسیدهای نیتروژن از منابع زیستی حاصل میشود، اما 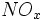 که به عنوان آلاینده جوی محسوب میشود، از نیروگاهها و دود اگزوز خودروها ناشی میشود. که به عنوان آلاینده جوی محسوب میشود، از نیروگاهها و دود اگزوز خودروها ناشی میشود.
باران اسیدی در آمریکای جنوبی
پیرامون معضل باران اسیدی ، به ویژه در مورد مناطق صنعتی که میزان PH کمتر از 3 دارند، تاکنون مقالات زیادی منتشر شده است. با وجود این بعضی از محققین معتقدند که برخی از این مقالات مستند نیستند و PH طبیعی باران توسط فعالیتهای مختلف انسانی ، چنان تغییر میکند که تعیین یک استاندارد ، غیرممکن میباشد. در ارتباط با این مطلب میتوان مثالهایی از آمریکای جنوبی زد. جایی که میزان PH آب باران ، هم در جنگلهای آمازون و هم در شهرهای سائوپائولو و ریدوژانیرو و باربر 4،7 است. در جنگل آمازون موارد زیر در اسیدی شدن تاثیر اساسی دارند:
- اسیدسولفوریک که خود از اکسید شدن سولفید هیدروژن (از مواد فرار مناطق مردابی) تشکیل میشود.
- اسید آلی که از سوختن مواد آلی بوجود میآید.
عملکرد و آثار بارانهای اسیدی که بطور طبیعی مورد بررسی و مطالعه قرار گرفته است، ما را به سوی رخدادها زیستی فاجعهآمیز هدایت میکند. با وجود اینکه این پدیده منشا طبیعی دارد، محققان بر این باورند که عملکرد انسان در این رابطه بسیار تاثیر گذار است.
باران قلیائی
نکته مهمی که باید به آن اشاره کرد، این است که در بعضی از مواقع ، PH آب باران حتی در جو بسیار آلوده هم در 5،6 ثابت باقی میماند. دانشمندان این مسئله را به حضور ترکیبات قلیائی در کنار اسید نسبت میدهند.
چنانچه میزان ترکیبات قلیائی شدیدا افزایش یابد، PH باران به بیش از 7 نیز میرسد. در این صورت به جای باران اسیدی ، باران قلیائی خواهیم داشت. ضمنا گروهی از عناصر شیمیایی در جو وجود دارند که حالت اسیدی را طی واکنشهایی خنثی میکنند. خاک بیایانها ، منبع طبیعی و با ارزش این عناصر قلیایی است. از جمله منابع غیرطبیعی عناصر قلیایی آلوده کننده جو میتوان به کارخانههای تولید کننده سیمان و فعالیتهای استخراج معادن اشاره نمود.
اثرات بوم شناختی باران اسیدی
آلایندههای نوع اول هوا مانند 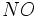 و و  آب باران را چندان اسیدی نمیکنند، اما این آلایندهها میتوانند طی چند ساعت یا چند روز به آلایندههای نوع دومی مثل آب باران را چندان اسیدی نمیکنند، اما این آلایندهها میتوانند طی چند ساعت یا چند روز به آلایندههای نوع دومی مثل 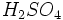 و و 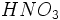 تبدیل شوند که هر دو در آب بسیار انحلال پذیر و جز اسیدهای قوی میباشند. در واقع تمام قدرت اسیدی در باران اسیدی ، به علت وجود این دو اسید است. تبدیل شوند که هر دو در آب بسیار انحلال پذیر و جز اسیدهای قوی میباشند. در واقع تمام قدرت اسیدی در باران اسیدی ، به علت وجود این دو اسید است.
میزان تأثیر باران اسیدی بر روی حیات زیست شناختی در یک منطقه به ترکیب خاک و صخره سنگی که در زیر لایه سطحی زمین آن منطقه واقع است، بستگی دارد. مناطقی که در زیر لایه سطحی زمین گرانیت یا کوارتز دارند، بیشتر تحت تاثیر قرار میگیرند، زیرا خاک وابسته به آن ، ظرفیت کمی برای خنثی کردن اسید دارد. چنانچه صخره سنگی در زیر لایه سطحی زمین از نوع سنگ آهک یا گچ باشد، اسید بطور موثر خنثی میشود، زیرا کربنات کلسیم به صورت باز عمل کرده و با اسید وارد واکنش میشود.
دریاچههای اسیدی شده به علت شسته شدن سنگها بوسیله یون هیدروژن دارای غلظتهای بالای آلومینیوم هستند. قدرت اسیدی بالا و غلظتهای بالای آلومینیوم عامل اصلی کاهش جمعیت ماهیهاست. ترکیب زیست شناختی دریاچههای اسیدی شده به شدت دچار تغییر میشود و تکثیر ماهیها در آبهای دارای قدرت اسیدی بالا کاهش مییابد. وقتی PH خیلی پایینتر از 5 باشد، گونههای اندکی زنده مانده و تولید مثل میکنند. آب دریاچههای اسیدی شده اغلب زلال و شفاف میباشد و این به علت از بین رفتن زندگی گیاهی و جانوری این دریاچهها میباشد.
تاثیر روی گیاهان و جنگلها
تاثیر باران اسیدی بر روی جنگلهای و محصولات کشاورزی را به دشواری میتوان تعیین کرد. ولی با این وجود بررسیهای آزمایشگاهی حاکی از این هستند که گیاهان زراعی رشد یافته در شرایط بارانهای اسیدی رفتار متفاوتی نشان میدهند. محصولات برخی افزایش یافته و محصولات گروهی کاهش مییابد.
آلودگی هوا اثرات بدی روی درختان دارد. اسیدی شدن خاک ، مواد غذایی موجود در آن را شسته و از بین میبرد. باران اسیدی که در جنگلها میریزد، ازن و سایر اکسندههای هوا ، که درختان جنگلی در معرض آنها قرار دارند، تاثیر نامطلوبی روی درختان و پوشش گیاهی میگذارد و این تاثیرات نامطلوب وقتی با خشکسالی ، دمای بالا و بیماری و … همراه باشد، ممکن است باعث خشک شدن درختان شود.
جنگلهای ارتفاعات بالا بیش از همه تحت تاثیر ریزش باران اسیدی هستند. قدرت اسیدی در مه و شبنم بیش از باران است، زیرا در مه و شبنم آبی که موجب رقیق شدن اسید شود، کمتر است. درختان برگ ریز که با باران اسیدی آسیب میبینند، به تدریج برگهای خود را از بالا به پائین از دست میدهند و اکثر برگهای خشک شده در بهار بعدی تجدید نمیشوند.
- بعضی از اثرات مهم باران های اسیدی که « فومارو » در سال 1997 نیز به آنها اشاره کرده است، عبارتند از:
- مضر برای انسان : ایجاد تنگی نفس ، برونشیت ، التهاب ریه ، آنفلوآنزا و سرماخوردگی
- تخریب جنگلها : ریختن برگها ، تخریب ریشه توسط باکتریها، کاهش روند رشد ، تقلیل میزان محصول دهی ، کم شدن قدرت حیات.
- خطرناک برای دریاچهها : مرگ صدها گونه زیستی
- تسریع در خوردگی مواد : خوردگی وسایل نقلیه و بناهای تاریخی
|